一、創新醫療器械注冊申報
依據《創新醫療器械特別審查程序》及醫療器械相關法規規定,國內外創新醫療器械注冊人在確保產品安全、有效的前提下,提交相應技術資料及證明性文件,提出創新醫療器械特別審查申請,進入創新醫療器械特別審查程序的注冊申請,審評早期介入并有專人負責,在產品檢測、體系核查及技術審評優先安排。
二、創新醫療器械適用條件
1. 申請人通過其主導的技術創新活動,在中國依法擁有產品核心技術發明專利權,或者依法通過受讓取得在中國發明專利權或其使用權,創新醫療器械特別審查申請時間距專利授權公告日不超過5年;或者核心技術發明專利的申請已由國務院專利行政部門公開,并由國家知識產權局專利檢索咨詢中心出具檢索報告,報告載明產品核心技術方案具備新穎性和創造性。
2. 申請人已完成產品的前期研究并具有基本定型產品,研究過程真實和受控,研究數據完整和可溯源。
3. 產品主要工作原理或者作用機理為國內首創,產品性能或者安全性與同類產品比較有根本性改進,技術上處于國際領先水平,且具有顯著的臨床應用價值。
三、創新醫療器械申報流程
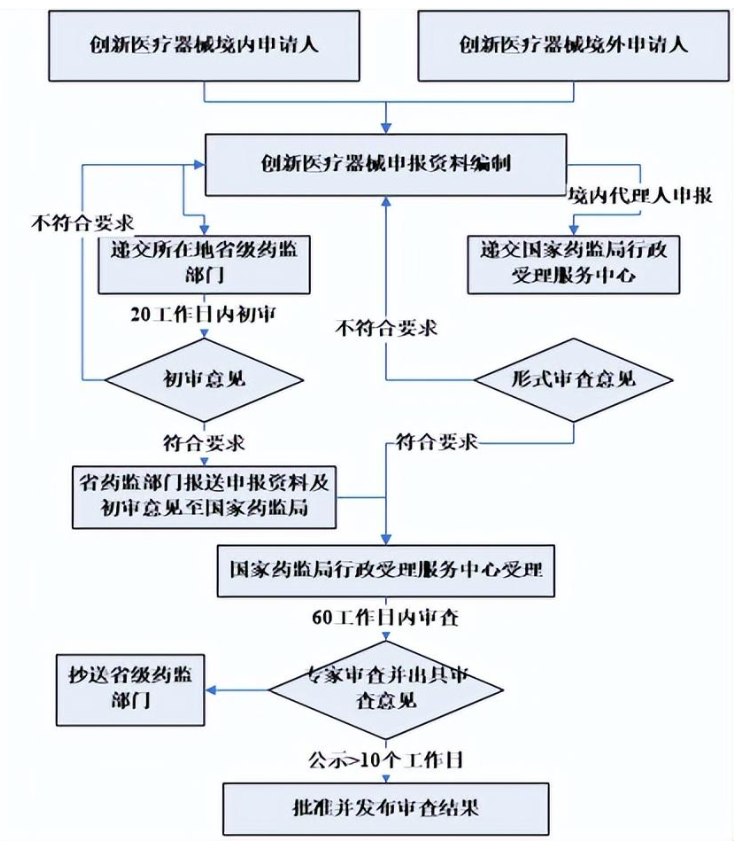
四、創新醫療器械特別審查申請資料要求
1. 創新醫療器械特別審查申請表
2. 申請人企業資質證明文件
3. 產品知識產權情況及證明文件
4. 產品研發過程及結果綜述
5. 產品技術文件,如產品適用范圍及預期用途、產品工作原理或作用機理、產品主要技術指標及確定依據、主要原材料及關鍵元器件的指標要求、主要生產工藝過程及流程圖、主要技術指標的檢驗方法等。
6. 產品創新的證明性文件
7. 產品風險分析資料
8. 產品說明書(樣稿)
9. 其它證明產品符合創新醫療器械的資料
10. 所提交資料真實性的自我保證聲明

